您现在的位置是:首页 >生活 > 2020-10-30 08:57:19 来源:
免疫系统受体被切断可能调节细胞活性
导读 麻省理工学院媒体实验室的研究人员发现,与免疫相关的蛋白质受体的缩短版本,长期以来被认为是不完整的,因此无功能,可以与细胞膜上的天然
麻省理工学院媒体实验室的研究人员发现,与免疫相关的蛋白质受体的缩短版本,长期以来被认为是不完整的,因此无功能,可以与细胞膜上的天然对应物结合,并可能代表新药物,疗法和仿生身体部位的途径。
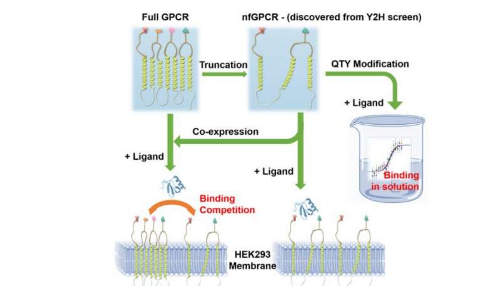
尽管以前认为具有截短结构的趋化因子受体在生物学上是无关紧要的,但在Cell Press的iScience期刊上发表的一篇论文报道,这两种受体的截短版本CXCR4和CCR5与它们相应的配体结合并在蛋白质功能中起作用。
“这一出人意料的发现,即短受体可以识别其各自的配体,这有可能为生物学的新调节系统带来新的前景。”媒体实验室分子机器小组分子结构实验室负责人,首席研究科学家张曙光说。 ,并且是该论文的高级作者。“这可能会激发研究人员提出被忽视的问题,并冒险超越当前的范式来发现,表征和设计蛋白质,并开发新技术和新医学。”
Zhang用日常类比来描述缩短的受体的结合能力。
他说:“感受器就像我们拿着茶杯的手。” “你不需要五个手指就能握住它。两个手指就足够了。”
天然形式的截短的受体蛋白是非水溶性的,要保持其结构,需要使用去污剂,这使它们的研究变得困难。为了避免使用去污剂,研究人员不得不使用Zhang的QTY编码将疏水性氨基酸替换为结构相似的亲水性氨基酸,从而将受体蛋白转化为水溶性形式。这一过程使研究人员能够在不使用去污剂的情况下研究趋化因子受体的生理和功能特性。受体也被重新转化为非水溶性形式以在体内观察到。
截短的受体的重新转化的天然变体不仅可以表达并将其自身定位在细胞膜上,以与它们各自的配体相互作用,而且还显示出对全长受体的调节作用,阻止了它们到达细胞表面。张指出,这种现象需要进一步研究和试验,但解释了这种现象如何可能导致阻止癌症等疾病的疗法。



















